Segundo este estudo, em apenas três meses após o contágio, os anticorpos do organismo já não reconhecem mais o vírus, sobretudo nos casos menos graves.
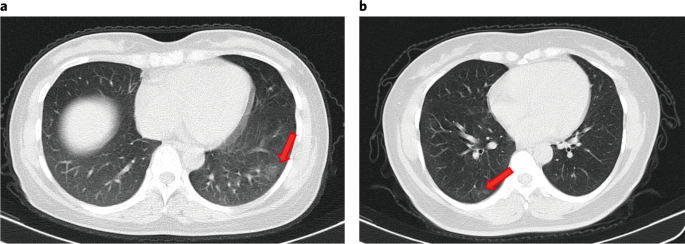
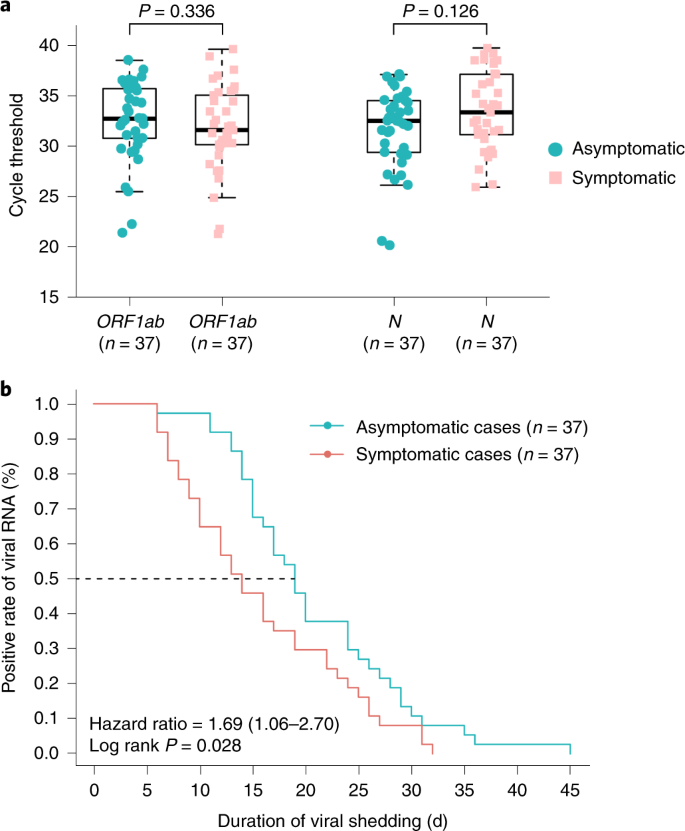
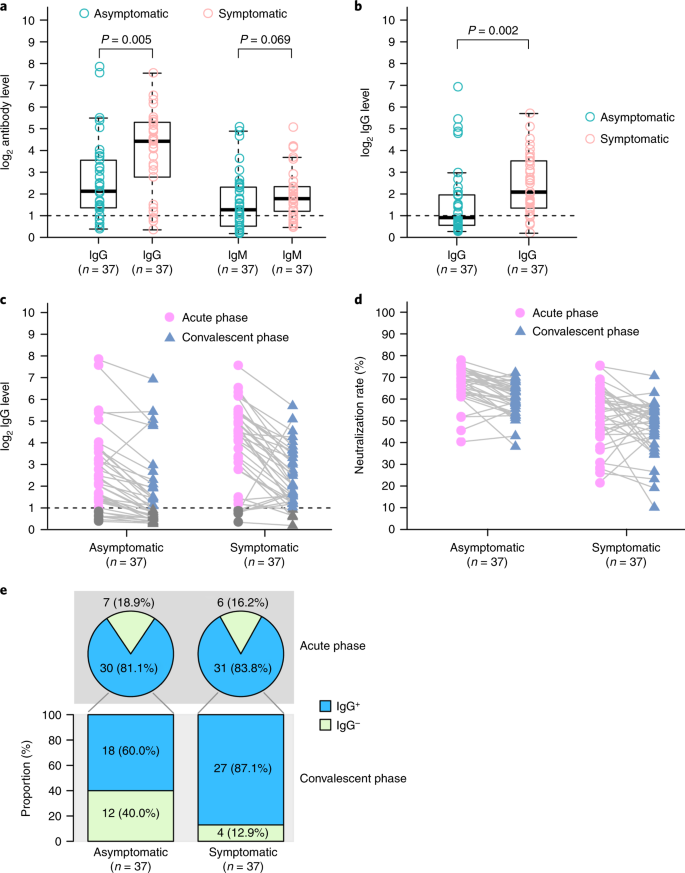
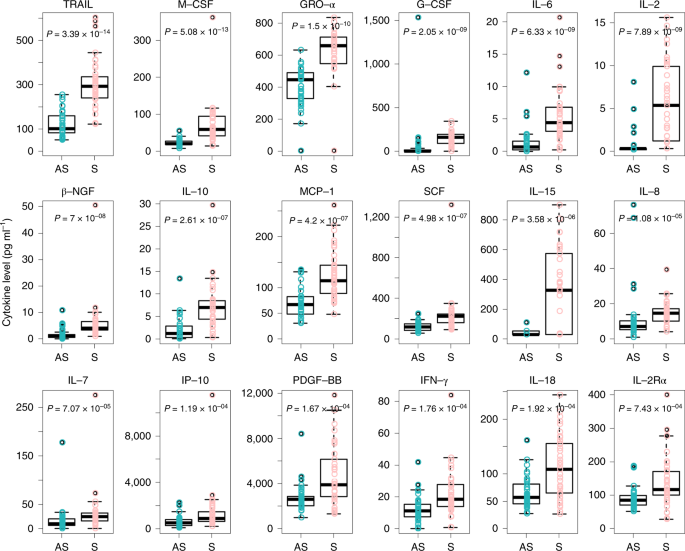
As características clínicas e as respostas imunes de indivíduos assintomáticos infectados com coronavírus 2 da síndrome respiratória aguda grave (SARS-CoV-2) não foram bem descritas. Estudamos 37 indivíduos assintomáticos no distrito de Wanzhou que foram diagnosticados com infecções por SARS-CoV-2 confirmadas por RT-PCR, mas sem sintomas clínicos relevantes nos 14 dias anteriores e durante a hospitalização. Indivíduos assintomáticos foram admitidos no Hospital Popular de Wanzhou, designado pelo governo, para isolamento centralizado, de acordo com a política 1 . A duração mediana do derramamento viral no grupo assintomático foi de 19 d (intervalo interquartil (IQR), 15–26 d). O grupo assintomático teve uma duração significativamente maior de derramamento viral do que o grupo sintomático (log-rank P = 0,028). Os níveis de IgG específicos para o vírus no grupo assintomático (mediana S / CO, 3,4; IQR, 1,6-10,7) foram significativamente menores ( P = 0,005) em relação ao grupo sintomático (mediana S / CO, 20,5; IQR, 5,8-38,2) na fase aguda. Dos indivíduos assintomáticos, 93,3% (28/30) e 81,1% (30/37) apresentaram redução nos níveis de IgG e de anticorpos neutralizantes, respectivamente, durante a fase convalescente precoce, em comparação com 96,8% (30/31) e 62,2% ( 23/37) de pacientes sintomáticos. Quarenta por cento dos indivíduos assintomáticos se tornaram soronegativos e 12,9% do grupo sintomático se tornaram negativos para IgG na fase convalescente inicial. Além disso, indivíduos assintomáticos exibiram níveis mais baixos de 18 citocinas pró e anti-inflamatórias. Esses dados sugerem que indivíduos assintomáticos tiveram uma resposta imune mais fraca à infecção por SARS-CoV-2. A redução nos níveis de IgG e de anticorpos neutralizantes na fase inicial de convalescença pode ter implicações para a estratégia de imunidade e pesquisas sorológicas. Em 24 de maio de 2020, a pandemia da doença de coronavírus 2019 (COVID-19), causada pela SARS-CoV-2, afetou mais de 5 milhões de pessoas em todo o mundo. A maioria dos pacientes com infecções por SARS-CoV-2 teve doença respiratória leve a grave com sintomas como febre, tosse e falta de ar, que podem aparecer 2 a 14 dias após a exposição. No entanto, existem outros pacientes diagnosticados por um teste positivo de RT-PCR, mas são assintomáticos ou minimamente sintomáticos 2 , 3 , 4 , 5 , 6 . Evidências crescentes têm mostrado que indivíduos assintomáticos podem espalhar o vírus com eficiência, e o surgimento desses espalhadores silenciosos da SARS-CoV-2 causou dificuldades no controle da epidemia 2, 5 . No entanto, nossa compreensão das características clínicas e respostas imunes de indivíduos assintomáticos com infecção por SARS-CoV-2 é limitada. Aqui descrevemos as características epidemiológicas e clínicas, níveis de vírus e respostas imunes em 37 indivíduos assintomáticos. Em 6 de fevereiro de 2020, a Comissão Nacional de Saúde da China atualizou o Plano de Prevenção e Controle COVID-19 (4ª edição) para o gerenciamento de contatos próximos, enfatizando a identificação e quarentena de indivíduos assintomáticos 1. Para identificar indivíduos assintomáticos, os Centros Distritais de Controle e Prevenção de Doenças de Wanzhou (CDC) realizaram uma triagem extensiva por RT-PCR para 2.088 contatos próximos em quarentena. Os indivíduos com resultados positivos de RT – PCR foram então rastreados por pesquisas de prevalência pontual realizadas pelo CDC local e avaliações de sintomas relatadas pelos clínicos. Desses, 60 indivíduos não declararam sintomas nos 14 dias anteriores, de acordo com os registros locais do CDC, e foram transferidos para um hospital designado pelo governo para isolamento centralizado. Na admissão, 17 indivíduos foram excluídos por sintomas leves ou atípicos, com base nas avaliações de sintomas relatadas pelos médicos; seis indivíduos que desenvolveram sintomas 4-17 d após a internação também foram excluídos. Finalmente, 37 casos assintomáticos, definidos como indivíduos com resultado positivo no teste de ácido nucleico, mas sem sintomas clínicos relevantes nos 14 dias anteriores e durante a hospitalização, foram incluídos neste estudo. Um total de 178 pacientes com infecções confirmadas por SARS-CoV-2 foram identificados no distrito de Wanzhou antes de 10 de abril de 2020, conforme rastreado pelos sistemas de vigilância do CDC. Neste estudo, a proporção de pacientes com infecções assintomáticas foi de 20,8% (37/178). Para detecção de anticorpos e medições de citocinas, 37 pacientes sintomáticos leves com combinação de sexo, idade e frequência e comorbidade foram selecionados para comparação com os indivíduos assintomáticos (Tabela Suplementar 1 ). Trinta e sete indivíduos controle do sexo feminino e idade do controle de Wanzhou District com resultados negativos de RT – PCR para SARS-CoV-2 também foram selecionados para comparação de citocinas. Dos 37 indivíduos assintomáticos, a idade média foi de 41 anos (variação de 8 a 75 anos) e 22 eram do sexo feminino. Vinte e oito indivíduos tinham histórico confirmado de contato com um paciente confirmado por RT-PCR com COVID-19 e nove eram residentes de Wuhan ou tinham um histórico de viagens a Wuhan antes do início da infecção (Tabela Suplementar 2 ). Um hemograma completo, bioquímica sangüínea, função de coagulação, biomarcadores de função hepática e renal e infecção foram medidos na admissão (Tabela Suplementar 2 ) para monitorar a progressão potencial da doença, de acordo com as Diretrizes de Tratamento COVID-19 (5ª edição) da National Health Comissão da China 7 . Dos 37 indivíduos assintomáticos, três apresentaram linfopenia e um trombocitopenia. Seis indivíduos apresentaram níveis elevados de alanina aminotransferase e 11 aumentaram os níveis de proteína C reativa. Na admissão, a tomografia computadorizada de tórax (TC) mostrou opacidade em vidro fosco focal em 11 indivíduos assintomáticos (11/37, 29,7%) e sombras com listras e / ou consolidação difusa em dez indivíduos (10/37, 27,0%), enquanto 16 indivíduos (16/37, 43,2%) não apresentaram anormalidades (fig. 1 ). Cinco indivíduos desenvolveram opacidades focais em vidro fosco ou sombras na TC do tórax em até 5 dias após a internação. Não houve derrame pleural, sinais de broncograma aéreo ou linfonodos aumentados, alterações típicas observadas em pacientes criticamente sintomáticos 8 , 9 , 10 . Achados radiológicos anormais confinados a um pulmão foram identificados em 66,7% (14/21) dos indivíduos assintomáticos, enquanto 33,3% (7/21) apresentaram anormalidades nos dois pulmões. Fig. 1: Tomografia computadorizada de tórax de dois pacientes assintomáticos. a , tomografia computadorizada de uma mulher de 45 anos, mostrando opacidades em vidro fosco no lobo inferior do pulmão esquerdo (seta). b , tomografia computadorizada de uma mulher de 50 anos, mostrando opacidades em vidro fosco e listras coexistindo no lobo inferior do pulmão direito (setas). Comparamos os valores do limiar do ciclo RT-PCR (Ct) dos primeiros swabs nasofaríngeos positivos para todos os 37 indivíduos assintomáticos e 37 pacientes sintomáticos. Os valores iniciais de Ct para 37 indivíduos assintomáticos e 37 pacientes sintomáticos pareciam semelhantes ( ORF1b 32,8 (IQR, 30,9-35,8) versus 31,7 (IQR, 30,3-35,1), P = 0,336; N 32,6 (IQR, 29,5-34,6) versus 33,5 ( IQR, 31,3-37,2), P = 0,126) (Fig. 2a) A duração mediana do derramamento viral, definida como o intervalo do primeiro ao último swab nasofaríngeo positivo, nos indivíduos assintomáticos, foi de 19 dias (IQR, 15–26 dias). A menor duração observada de derramamento viral foi de 6 dias, enquanto a maior foi de 45 dias. A duração mediana do derramamento viral foi de 14 dias (IQR, 9 a 22 dias) em pacientes com sintomas leves. O grupo assintomático teve uma duração significativamente maior de derramamento viral do que o grupo sintomático (log-rank P = 0,028) (Fig. 2b ). No entanto, o derramamento mensurável de vírus não equivale à infectividade viral, e é necessária uma avaliação adicional para determinar a carga viral respiratória de SARS-CoV-2 que está correlacionada com o vírus cultivável 11 . Fig. 2: Características virológicas em casos assintomáticos e sintomáticos. a , Os valores de Ct de ORF1b e N obtidos com RT-PCR foram detectados em zaragatoas nasofaríngeas dos grupos assintomáticos ( n = 37) e sintomáticos ( n = 37). Os gráficos das caixas mostram as medianas (linha do meio) e o primeiro e o terceiro quartis (caixas), enquanto os bigodes mostram 1,5 × o IQR acima e abaixo da caixa. Os valores de teste P de Mann-Whitney U não pareados e emparelhados são representados nas parcelas, e o ponto de corte significativo do valor de P foi fixado em 0,05. b, O método Kaplan-Meier foi utilizado para estimar a taxa positiva de RNA viral, e o teste log-rank bilateral foi aplicado para avaliar a diferença de significância da duração do derramamento viral nos grupos sintomático e assintomático. Para investigar a resposta aguda de anticorpos à infecção por SARS-CoV-2, IgG e IgM específicas para vírus foram medidas em amostras de soro de indivíduos assintomáticos e sintomáticos. No grupo assintomático, 81,1% (30/37) apresentaram resultado positivo para IgG e 83,8% (31/37) do grupo sintomático apresentaram resultado positivo para IgG aproximadamente 3-4 semanas após a exposição. Além disso, 62,2% (23/37) do grupo assintomático foram positivos para IgM, enquanto 78,4% (29/37) do grupo sintomático foram positivos para IgM. Curiosamente, os níveis de IgG no grupo sintomático (mediana S / CO, 20,5; IQR, 5,8-38,2) foram significativamente mais altos do que os do grupo assintomático (mediana S / CO, 3,4; IQR, 1,6-10,7) na fase aguda ( o período em que o RNA viral pode ser encontrado em uma amostra respiratória) ( P = 0,005) (Fig. 3a ). Fig. 3: Níveis de IgG e IgM nas fases aguda e convalescente em pacientes infectados com SARS-CoV-2. a , A comparação dos níveis de anticorpos específicos para vírus em pacientes assintomáticos ( n = 37) e pacientes sintomáticos ( n = 37) com infecções agudas. b , níveis de IgG em pacientes com COVID-19 em fase convalescente que receberam alta do hospital. c , Alterações dinâmicas nos níveis de IgG específicos para vírus nas fases aguda e convalescente. d) Alterações dinâmicas nos anticorpos séricos neutralizantes nas fases aguda e convalescente. Os resultados são expressos como a média de duas experiências independentes. e , proporções IgG-positivas de pacientes com COVID-19 nas fases aguda e convalescente. Os diagramas de caixa em um e bmostre as medianas (linha do meio) e primeiro e terceiro quartis (caixas), e os bigodes mostram 1,5 × o IQR acima e abaixo da caixa. Os valores de teste P de Mann-Whitney U não pareados e emparelhados são representados nas parcelas, e o ponto de corte significativo do valor de P foi fixado em 0,05. Também acompanhamos 37 indivíduos assintomáticos e 37 pacientes sintomáticos até a fase convalescente inicial (8 semanas após receber alta do hospital). Os níveis de IgG no grupo sintomático ainda eram significativamente maiores do que os do grupo assintomático na fase convalescente inicial ( P = 0,002) (Fig. 3b ). Surpreendentemente, os níveis de IgG em 93,3% (28/30) do grupo assintomático e 96,8% (30/31) do grupo sintomático diminuíram durante a fase convalescente inicial (Fig. 3c ). A porcentagem mediana de redução foi de 71,1% (variação de 32,8 a 88,8%) para os níveis de IgG no grupo assintomático, enquanto a porcentagem mediana de redução foi de 76,2% (variação de 10,9 a 96,2%) no grupo sintomático. Usando um ensaio de neutralização baseado em pseudovírus (Métodos ), também observamos uma diminuição nos níveis séricos neutralizantes de anticorpos em 81,1% (30/37) do grupo assintomático e em 62,2% (23/37) do grupo sintomático. A porcentagem mediana de redução foi de 8,3% (variação de 0,5 a 22,8%) para a neutralização de anticorpos séricos no grupo assintomático, enquanto a porcentagem mediana de redução foi de 11,7% (variação de 2,3 a 41,1%) no grupo sintomático (fig. 3d ) Além disso, 40,0% (12/30) dos indivíduos assintomáticos, mas apenas 12,9% (4/31) dos indivíduos sintomáticos, tornaram-se soronegativos para a IgG (Fig. 3e ). Para elucidar ainda mais as respostas imunes associadas à infecção por SARS-CoV-2, os níveis séricos de citocinas e quimiocinas foram comparados entre os grupos assintomáticos e sintomáticos. Concentrações elevadas de 18 citocinas pró e anti-inflamatórias foram observadas no grupo sintomático em comparação ao grupo assintomático. Destes, ligante indutor de apoptose relacionado ao fator de necrose tumoral (TRAIL) ( P = 3,39 × 10-14 ), fator estimulador de colônias de macrófagos (M-CSF) ( P = 5,08 × 10−13 ), oncogene regulado pelo crescimento α (GRO-α) ( P = 1,5 × 10-10 ), fator estimulador de colônias de granulócitos (G-CSF) ( P = 2,05 × 10 -9 ) e interleucina 6 (IL-6) (P = 6,33 × 10−9 ) mostrou as alterações mais significativas (Fig. 4 e Dados estendidos Fig. 1 ). Além disso, as citocinas foram posteriormente analisadas no grupo assintomático e nos 37 controles saudáveis. Os níveis plasmáticos de 32 citocinas foram semelhantes entre os controles saudáveis e os indivíduos assintomáticos. Níveis significativamente mais altos de fator de célula-tronco (SCF) ( P = 1,48 × 10-9 ), IL-13 ( P = 3,75 × 10 -7 ), IL-12 p40 ( P = 7,08 × 10 -6 ) e fator inibidor de leucemia (LIF) ( P = 1,33 × 10-3 ) foram encontrados no grupo assintomático (Dados Estendidos Fig. 2 ) Coletivamente, nossos dados mostram que os indivíduos assintomáticos tiveram uma resposta inflamatória reduzida, caracterizada por baixas concentrações circulantes de citocinas e quimiocinas. Fig. 4: Comparação das concentrações séricas de citocina / quimiocina entre os grupos assintomáticos e sintomáticos. Amostras de pacientes assintomáticos ( n = 37) e sintomáticos ( n = 37) com COVID-19 foram coletadas na fase aguda durante a hospitalização, e foram realizados ensaios para medir as concentrações de 48 citocinas e quimiocinas. Os gráficos das caixas mostram as medianas (linha do meio) e o primeiro e o terceiro quartis (caixas), e os bigodes mostram 1,5 × o IQR acima e abaixo da caixa. Os valores de P do teste U de Mann-Whitney não pareados e emparelhados são representados nas parcelas, e o ponto de corte significativo do valor de P foi estabelecido em 0,001. As características clínicas e as respostas imunes de indivíduos assintomáticos infectados com SARS-CoV-2 não foram bem descritas. Dos 178 pacientes confirmados em laboratório, 37 que nunca desenvolveram sintomas ao longo do curso da doença foram incluídos neste estudo. Nossos dados mostraram que 20,8% desses pacientes apresentavam infecções assintomáticas. No entanto, isso pode não ser uma estimativa precisa da proporção de infecções assintomáticas na população em geral, devido ao fato de que infecções assintomáticas foram identificadas entre aqueles com alto risco de infecção (incluindo contatos próximos e indivíduos com histórico de viagens a Wuhan ) e não de uma amostra aleatória de pessoas. Portanto, a proporção de infecções assintomáticas precisa ser determinada através da triagem populacional 12. Além disso, a proporção de infecções assintomáticas pode ser ainda maior, pois alguns casos podem ser perdidos pelo teste de RT-PCR. Nosso grupo identificou com sucesso sete pacientes com infecção por SARS-CoV-2 de 148 casos com resultados negativos de RT – PCR e sem sintomas usando um teste de anticorpos 13 . Portanto, RT-PCR e testes sorológicos oportunos devem ser usados em conjunto, o que beneficiaria a estimativa precisa da proporção assintomática. No entanto, o teste sorológico tem limitações e os testes variam em sua especificidade e sensibilidade. Os resultados também podem ser confundidos por anticorpos já existentes para SARS-CoV, MERS-CoV ou coronavírus resfriado comum. Até o momento, a duração do derramamento de RNA de SARS-CoV-2 não foi bem caracterizada. No SARS-CoV, o RNA viral foi detectável em diferentes amostras, incluindo esfregaços na garganta, fezes e urina, em mais de 30% dos pacientes por até 4 semanas após o início da doença 14 . Nas infecções por MERS-CoV, o derramamento viral nas secreções respiratórias persistiu por pelo menos 3 semanas 15 . Recentemente, um estudo de 191 pacientes com COVID-19 relatou que a duração mediana do derramamento viral foi de 20 dias em sobreviventes (variação de 8 a 37 dias) 16 . Em outro relatório, a duração do derramamento viral nos aspirados nasofaríngeos foi prolongada até pelo menos 24 dias após o início dos sintomas em 18 pacientes infectados com SARS-CoV-2 em Cingapura 17. Neste estudo, a duração mediana do derramamento viral em 37 pacientes com sintomas leves foi de 14 dias, menor do que em relatórios anteriores. Em comparação com pacientes sintomáticos, o grupo assintomático teve uma duração significativamente maior de derramamento viral, com um tempo de derramamento viral de 19 dias. Vários fatores podem contribuir para a variação da duração do derramamento viral em diferentes estudos, incluindo a gravidade da doença, definição da duração do derramamento viral e frequência da coleta de amostras. Notavelmente, a detecção do RNA viral não significa necessariamente que o vírus infeccioso esteja presente nas amostras respiratórias, e é necessário cuidado ao aplicar a duração do derramamento de vírus, calculada com base na RT-PCR para avaliar o potencial de infecção. A força e a duração da imunidade após a infecção são questões-chave para a ‘imunidade ao escudo’ 18 e para informar decisões sobre como e quando aliviar as restrições de distanciamento físico 19 , 20 . Estudos anteriores demonstraram que os anticorpos circulantes contra SARS-CoV ou MERS-CoV duram pelo menos 1 ano 21 , 22 . Os níveis sustentados de IgG foram mantidos por mais de 2 anos após a infecção por SARS-CoV 23 , 24 . As respostas de anticorpos em indivíduos com infecção por MERS-CoV confirmada em laboratório duraram pelo menos 34 meses após o surto 25. Recentemente, vários estudos que caracterizam respostas imunes adaptativas à infecção por SARS-CoV-2 relataram que a maioria dos indivíduos convalescentes com COVID-19 possui anticorpos neutralizantes detectáveis, que se correlacionam com o número de células T específicas do vírus 26 , 27 , 28 , 29 . Neste estudo, observamos que os níveis de IgG e anticorpos neutralizantes em uma alta proporção de indivíduos que se recuperaram da infecção por SARS-CoV-2 começam a diminuir dentro de 2-3 meses após a infecção. Em outra análise da dinâmica dos títulos de anticorpos neutralizantes em oito pacientes convalescentes com COVID-19, quatro pacientes apresentaram redução de anticorpos neutralizantes aproximadamente 6 a 7 semanas após o início da doença 30. Um modelo matemático também sugere uma curta duração da imunidade após a infecção por SARS-CoV-2 31 . Juntos, esses dados podem indicar os riscos do uso de ‘passaportes de imunidade’ do COVID-19 e apoiar o prolongamento de intervenções de saúde pública, incluindo distanciamento social, higiene, isolamento de grupos de alto risco e testes generalizados. Estudos sorológicos longitudinais adicionais com perfil de indivíduos mais sintomáticos e assintomáticos são urgentemente necessários para determinar a duração da imunidade mediada por anticorpos. Além disso, baixos níveis de IgG anti-viral em pacientes assintomáticos, com maior probabilidade de se tornar soronegativos, apóiam ainda mais a necessidade de uma rápida soroconversão para estudar a verdadeira taxa de infecção. Entre 21 de janeiro e 19 de fevereiro de 2020, 25 pacientes sintomáticos importados (registrados no distrito de Wanzhou), que retornaram da cidade de Wuhan ou da província de Hubei, foram confirmados com infecção por SARS-CoV-2 com base em um teste positivo de RT-PCR no distrito de Wanzhou. (Wanzhou é a região mais atingida da cidade de Chongqing, um município no nível de província adjacente à província de Hubei.) Até 10 de abril de 2020, um total de 2.088 indivíduos, incluindo contatos próximos de pacientes confirmados e pessoas que retornavam de Wuhan, foram colocados em quarentena pelo CDC local e testados por RT-PCR. Desses 2.088 indivíduos, 93 desenvolveram sintomas e testaram positivo para SARS-CoV-2. Em 6 de fevereiro de 2020, a Comissão Nacional de Saúde da China atualizou o Plano de Prevenção e Controle COVID-19 (4ª edição) para o gerenciamento de contatos próximos, enfatizando a identificação e quarentena de indivíduos assintomáticos. O CDC local realizou uma extensa triagem de RT – PCR de indivíduos em quarentena. Depois que um caso foi confirmado positivo por RT – PCR, a primeira pesquisa de prevalência foi realizada pela equipe local do CDC. Os indivíduos que confirmaram ter COVID-19 foram solicitados a fornecer informações, incluindo demografia (dados de nascimento, sexo e doença renal), condições pré-existentes (incluindo histórico de hipertensão, diabetes mellitus, doença cardiovascular, doença cerebrovascular, doença pulmonar crônica, doença renal, hepatopatia crônica e doenças de imunodeficiência) e sintomas, bem como registros de triagem para os 14 dias anteriores (incluindo febre, tosse, expectoração, falta de ar, frio, mialgia, dor de garganta, corrimento nasal, angústia no peito, dor de cabeça, diarréia, vômito e náusea). De acordo com o Plano de Controle e Prevenção COVID-19 (4ª edição), 60 indivíduos assintomáticos com base em triagem preliminar foram identificados e transferidos para um hospital designado pelo governo para isolamento centralizado. Na admissão, as entrevistas individuais foram realizadas pelos clínicos para corroborar as afirmações assintomáticas. Após essa triagem, 17 indivíduos foram excluídos por sintomas leves ou atípicos. Os médicos realizam a triagem diária dos sintomas assim que um indivíduo é internado no hospital. Quatro a 17 dias após a admissão, seis desses 43 indivíduos previamente assintomáticos desenvolveram sintomas e foram recategorizados como sintomáticos. Não ficou claro se indivíduos que apresentam infecção assintomática podem progredir para doença clínica durante a fase inicial da epidemia de SARS-CoV-2 na China. Portanto, os médicos chineses optaram por administrar inalação de interferon alfa (IFN-α), tratamento antiviral (ribavirina por via oral) e tratamento de suporte (tratamento para fortalecer a imunidade, como timopentina e medicina chinesa) para evitar possíveis agravamentos, de acordo com o COVID-19 Diretrizes de tratamento (5ª edição) dos Institutos Nacionais de Saúde da China, publicado em 8 de fevereiro de 2020. A estratégia de isolamento e tratamento de infecções assintomáticas deve ser atualizada de acordo com as diretrizes oficiais em diferentes países. Em seguida, 37 pacientes sintomáticos com sexo, idade e frequência de comorbidade foram selecionados para comparação com os indivíduos assintomáticos (Tabela Suplementar 1 ). Trinta e sete controles pareados por frequência de sexo e idade com resultados negativos de RT-PCR para SARS-CoV-2 também foram incluídos neste estudo. Foram excluídos indivíduos com doenças pulmonares, hepáticas, renais, cardiovasculares, metabólicas ou de imunodeficiência. Dados epidemiológicos, demográficos, de contato e exposição, apresentações clínicas, tomografia computadorizada de tórax, exames laboratoriais, tratamento e resultados foram coletados em prontuários médicos. Os dados laboratoriais coletados para cada paciente incluíram hemograma completo, perfil de coagulação, testes bioquímicos séricos (incluindo função renal e hepática, eletrólitos, lactato desidrogenase e creatina quinase), ferritina sérica e biomarcadores de infecção. A tomografia computadorizada do tórax foi realizada em todos os pacientes internados. Para identificar a infecção por SARS-CoV-2, os swabs nasofaríngeos foram coletados pelo menos duas vezes e testados por RT – PCR. O RNA de todas as amostras foi isolado dentro de 24 h. As amostras de RNA viral foram extraídas de acordo com as instruções do fabricante, usando o Nucleotide Acid Extraction Kit (DAAN Gene, registro no. 20170583), que foi baseado em um procedimento automatizado de purificação de esferas magnéticas. Um kit comercial de RT – PCR (DAAN Gene, número de registro 20203400063) foi usado para testar amostras de SARS-CoV-2. Resumidamente, dois genes-alvo, incluindo o quadro de leitura aberta 1ab ( ORF1ab ) e a proteína nucleocapsídeo ( N ), foram simultaneamente amplificados e testados durante a RT-PCR. Os iniciadores do teste de RT-PCR para SARS-CoV-2 estavam de acordo com a recomendação do CDC chinês ( ORF1abencaminhar: CCCTGTGGGTTTTACACTTAA, ORF1ab reverso: ACGATTGTGCATCAGCT GA, sonda ORF1ab : 5′-CCGTCTGCGGTATGTGGAAAGGTTATGG-3 ‘(marcado com corante FAM); N para a frente: GGGGAACTTCTCCTGCTAGAAT, N para a frente: CAGACATT. Sonda TTGCTCTCAAGCTG, N : 5′-TTGCTGCTGCTTGACAGATT-3 ‘(corante VIC marcado)). Ciclagem de PCR: 50 ° C por 15 min, 95 ° C por 15 min, 45 ciclos contendo 94 ° C por 15 s, 55 ° C por 45 s (coleta de fluorescência). Valores de Ct menores que 37 e maiores que 40 foram definidos como positivo e negativo, respectivamente, para ambos os genes. Amostras com valores de Ct de 37 a 40 foram definidas como inconclusivas e foi necessário um segundo teste. A partir de 1 semana após a admissão, as amostras nasofaríngeas foram testadas por RT – PCR a cada 2-3 dias pelo restante do período de hospitalização. Pacientes com um resultado positivo de RT-PCR foram definidos como pacientes com infecção por SARS-CoV-2. Pacientes com dois resultados negativos consecutivos de RT – PCR foram definidos como negativos para SARS-CoV-2. Um caso confirmado de COVID-19 foi definido como um indivíduo com swabs nasofaríngeos positivos para SARS-CoV-2, usando PCR em laboratório. Os pacientes sintomáticos foram definidos como pacientes com COVID-19 confirmado em laboratório, com sintomas como febre, tosse, dor de garganta e escarro. Um caso assintomático foi definido como um indivíduo com resultado positivo no teste de ácido nucleico, mas sem sintomas clínicos relevantes nos 14 dias anteriores e durante a hospitalização. Um contato próximo foi definido como (1) qualquer pessoa que estivesse a aproximadamente 2 metros de uma pessoa infectada com SARS-CoV-2 por mais de 10 minutos e (2) aquelas que tiveram contato direto com as secreções infecciosas de um paciente COVID-19. Pode ocorrer contato próximo ao cuidar, morar, visitar ou compartilhar uma área de espera de saúde ou um quarto com pacientes com COVID-19. A duração do derramamento foi calculada como o número de dias desde a primeira amostra positiva nasofaríngea até a última amostra positiva, com base no teste RT-PCR. A última amostra positiva foi seguida por um resultado negativo de RT – PCR em dois testes seqüenciais. IgG e IgM contra SARS-CoV-2 foram detectados em amostras de plasma usando kits de imunoensaio de enzima de quimioluminescência magnética (Bioscience), de acordo com as instruções do fabricante. Resumidamente, os antígenos recombinantes contendo a nucleoproteína e um peptídeo (LQPELDSFKEELDKYFKNHTSPDVD) da proteína spike de SARS-CoV-2 foram imobilizados em partículas magnéticas. Um pico otimizado para códons ( S) que não possuíam os 19 aminoácidos C-terminais foi usado para gerar um pseudovírus que expressa luciferase. O ensaio de neutralização do pseudovírus SARS-CoV-2 foi realizado em células 293T que expressam ACE2 em uma placa de 96 poços. Foram obtidos soros diluídos emparelhados (1: 600) de um indivíduo (uma amostra de soro da fase aguda e outra amostra de soro da fase convalescente), foram adicionados volumes iguais de pseudovírus SARS-CoV-2 e as placas foram pré-incubadas em 37 ° C por 1 h. Em seguida, as células 293T que expressam ACE2 foram incubadas com 100 mL de mistura SERA-pseudovírus por 24 h. Três dias após a infecção, as células foram lisadas com 30 μl de tampão de lise (Promega) para medir a transdução pseudoviral. As unidades de luminescência relativa da atividade da luciferase foram detectadas usando o Luciferase Assay Kit (Promega), de acordo com as instruções do fabricante. As experiências foram repetidas duas vezes. A atividade da luciferase foi determinada pelo luminômetro de microplacas GloMax (Promega). A taxa de neutralização (%) foi calculada da seguinte forma: Os soros de pacientes com infecções por SARS-CoV-2 confirmadas em laboratório (grupo assintomático n = 37 e grupo sintomático n = 37) foram coletados o mais cedo possível durante a hospitalização. Os soros de indivíduos saudáveis ( n = 37) foram incluídos como grupos controle. As concentrações de 48 citocinas e quimiocinas foram medidas usando o Painel de Triagem de Citocinas Humanas Bio-Plex (48-Plex nº 12007283, Bio-Rad) em um Luminex 200 (Luminex Multiplexing Instrument, Merck Millipore) seguindo as instruções do fabricante. O painel de triagem de 48 citocinas inclui: fator de crescimento de fibroblastos (FGF), eotaxina, fator estimulador de colônias de granulócitos (G-CSF), fator estimulador de colônias de granulócitos e macrófagos (GM-CSF), interferon gama (IFN-γ), interleucina -1 beta (IL-1β), antagonista do receptor de interleucina 1 (IL-1RA), interleucina 1 alfa (IL-1α), interleucina-2 receptor alfa (IL-2Rα), interleucina-3 (IL-3), interleucina -12 p40 (IL-12 (p40)), interleucina-16 (IL-16), interleucina-2 (IL-2), interleucina-4 (IL-4), interleucina-5 (IL-5), interleucina- 6 (IL-6), interleucina-7 (IL-7), Todas as características contínuas são descritas como medianas (IQRs) e as características categóricas são descritas como números (%). Diferenças significativas de características contínuas entre os grupos controle assintomático e sintomático e assintomático e saudável foram determinadas pelo teste U de Mann-Whitney. A comparação das características categóricas foi realizada com o teste exato de Fisher. Valores de p de 0,05 para anticorpo e 0,001 para citocinas indicaram significância. O método de Kaplan-Meier foi utilizado para analisar a duração do derramamento viral nos grupos sintomático e assintomático. As análises estatísticas foram realizadas no software R (versão 3.6.0). O estudo foi aprovado pela Comissão de Ética da Universidade Médica de Chongqing (referência nº 2020004 ). O consentimento informado por escrito para a participação neste estudo foi obtido de todos os participantes adultos ou responsáveis em nome das crianças matriculadas neste estudo. Informações adicionais sobre o design da pesquisa estão disponíveis no Resumo dos Relatórios de Pesquisa da Natureza, vinculado a este artigo. Os dados brutos deste estudo são fornecidos no conjunto de dados suplementar . Dados de suporte adicionais estão disponíveis dos autores correspondentes, mediante solicitação razoável. Todas as solicitações de dados e materiais brutos e analisados serão revisadas pelos autores correspondentes para verificar se a solicitação está sujeita a quaisquer obrigações de propriedade intelectual ou confidencialidade. Os dados de origem são fornecidos com este documento. Plano de Controle e Prevenção COVID-19 , 4ª edição (Comissão Nacional de Saúde da República Popular da China, 2020). Hu, Z. et ai. Características clínicas de 24 infecções assintomáticas com COVID-19 examinadas entre contatos próximos em Nanjing, China. Sci. China Life Sci. 63 , 706-711 (2020). Chan, JF et al. Um cluster familiar de pneumonia associado ao novo coronavírus de 2019, indicando a transmissão de pessoa para pessoa: um estudo de um cluster familiar. Lancet 395 , 514-523 (2020). Nishiura, H. et ai. Estimativa da proporção assintomática de novas infecções por coronavírus (COVID-19). Int J. Infect. Dis. 94 , 154-155 (2020). Bai, Y. et al. Presumida transmissão portadora assintomática de COVID-19. JAMA 323 , 1406-1407 (2020). Mizumoto, K., Kagaya, K., Zarebski, A. & Chowell, G. Estimando a proporção assintomática de casos de doença por coronavírus 2019 (COVID-19) a bordo do navio de cruzeiro Diamond Princess, Yokohama, Japão, 2020. Euro. Surveill. 25 , 2000-180 (2020). Diretrizes de tratamento COVID-19 , 5ª edição (Comissão Nacional de Saúde da República Popular da China, 2020). Xiong, Y. et ai. Características clínicas e de TC de alta resolução da infecção por COVID-19: comparação das alterações iniciais e de acompanhamento. Investir. Radiol. 55 , 332-339 (2020). Chen, N. et ai. Características epidemiológicas e clínicas de 99 casos de 2019 nova pneumonia por coronavírus em Wuhan, China: um estudo descritivo. Lancet 395 , 507-513 (2020). Wang, D. et ai. Características clínicas de 138 pacientes hospitalizados com 2019 nova pneumonia infectada por coronavírus em Wuhan, China. JAMA 323 , 1061-1069 (2020). Atkinson, B. & Petersen, E. SARS-CoV-2, derramamento e infecciosidade. Lancet 395 , 1339–1340 (2020). Gudbjartsson, DF, et al. Propagação de SARS-CoV-2 na população islandesa. N. Engl. J. Med. https://doi.org/10.1056/NEJMoa2006100 (2020). Long, QX, et al. Respostas de anticorpos à SARS-CoV-2 em pacientes com COVID-19. Nat. Med. https://doi.org/10.1038/s41591-020-0897-1 (2020). Xu, D. et ai. Derramamento persistente de SARS-CoV viável na urina e fezes de pacientes com SARS durante a fase convalescente. EUR. J. Clin. Microbiol. Infectar. Dis. 24 , 165-171 (2005). Oh, MD et al. Cinética da carga viral da infecção por coronavírus MERS. N. Engl. J. Med. 375 , 1303-1305 (2016). Zhou, F. et ai. Curso clínico e fatores de risco para mortalidade de pacientes adultos internados com COVID-19 em Wuhan, China: um estudo de coorte retrospectivo. Lancet 395 , 1054-1062 (2020). Young, BE et al. Características epidemiológicas e evolução clínica de pacientes infectados com SARS-CoV-2 em Cingapura. JAMA 323 , 1488-1494 (2020). Weitz, JS, et al. Modelando a imunidade do escudo para reduzir a propagação da epidemia do COVID-19. Nat. Med. https://doi.org/10.1038/s41591-020-0895-3 (2020). Norheim, OF Protegendo a população com indivíduos imunes. Nat. Med. https://doi.org/10.1038/s41591-020-0895-3 (2020). Phelan, AL COVID-19: passaportes de imunidade e certificados de vacinação: desafios científicos, equitativos e legais. Lancet 395 , 1595-1598 (2020). Cao, WC, Liu, W., Zhang, PH, Zhang, F. & Richardus, JH Desaparecimento de anticorpos para o coronavírus associado à SARS após a recuperação. N. Engl. J. Med. 357 , 1162-1163 (2007). Choe, PG et al. Respostas de anticorpos MERS-CoV 1 ano após o início dos sintomas, Coréia do Sul, 2015. Emerg. Infectar. Dis. 23 , 1079-1084 (2017). Guo, X. et al. Persistência a longo prazo de anticorpos IgG em profissionais de saúde infectados com SARS-CoV. Pré-impressão em https://www.medrxiv.org/content/10.1101/2020.02.12.20021386v1 (2020). Wu, LP et al. Duração das respostas de anticorpos após síndrome respiratória aguda grave. Emerg. Infectar. Dis. 13 , 1562-1564 (2007). Payne, DC et al. Persistência de anticorpos contra o coronavírus da síndrome respiratória do Oriente Médio. Emerg. Infectar. Dis. 22 , 1824-1826 (2016). Ni, L. et ai. Detecção de imunidade humoral e celular específica de SARS-CoV-2 em indivíduos convalescentes COVID-19. Imunidade https://doi.org/10.1101/2020.03.17.20037713 (2020). Thevarajan, I. et al. Amplitude de respostas imunes concomitantes antes da recuperação do paciente: relato de caso de COVID-19 não grave. Nat. Med. 26 , 453-455 (2020). Wu, F. et ai. As respostas de anticorpos neutralizantes ao SARS-CoV-2 em uma coorte de pacientes com COVID-19 recuperaram e suas implicações. Pré-impressão em https://www.medrxiv.org/content/10.1101/2020.03.30.20047365v2 (2020). Suthar, MS, et al. Rápida geração de respostas de anticorpos neutralizantes em pacientes com COVID-19. Pré-impressão em https://www.medrxiv.org/content/10.1101/2020.05.03.20084442v1 (2020). Wang, X. et al. Respostas de anticorpos neutralizantes à SARS-CoV-2 em pacientes com COVID-19 e em convalescentes. Pré-impressão em https://www.medrxiv.org/content/10.1101/2020.04.15.20065623v3 (2020). Kissler, SM, Tedijanto, C., Goldstein, E., Grad, YH e Lipsitch, M. Projetando a dinâmica de transmissão do SARS-CoV-2 durante o período pós-pandemia. Science 368 , 860–868 (2020). Agradecemos C.-Y. Yang e B. Anderson pela revisão crítica do manuscrito. Este estudo recebeu o seguinte financiamento: Projeto Nacional de Ciência e Tecnologia (2017ZX10202203); o Projeto de Emergência da Comissão de Ciência e Tecnologia de Chongqing; e a Fundação Nacional de Ciências Naturais da China (concessão nº 81871656 e 8181101099). Agradecemos a todos os pacientes envolvidos no estudo.a Principal
Resultados
Características demográficas
Achados radiológicos e laboratoriais
Resultados virológicos
IgG e IgM específicas para vírus em indivíduos assintomáticos
Citocinas em indivíduos assintomáticos
Discussão
Métodos
Desenho do estudo e participantes
Coleção de dados
Definições
Detecção de IgG e IgM contra SARS-CoV-2
Detecção de neutralização usando o teste de neutralização de pseudovírus
Medição de citocinas
Análise estatística
Aprovação ética
Resumo dos Relatórios
Disponibilidade de dados
Referências
Reconhecimentos


















Add Comment